
A menudo, al percibir el tumor como una lesión, el tejido conectivo que lo rodea se reestructura como ocurre en el proceso de reparación de heridas. Esta reacción es inducida por moléculas (como la citoquina TGFβ) liberadas por células epiteliales tumorales o de heridas que actúa sobre los fibroblastos del estroma y es característica de tumores epiteliales en órganos blandos, como la mama, el pulmón o el intestino. Como resultado de esta reacción, se genera un estroma peritumoral desmoplásico rico en fibras de fibronectina y colágeno. La desmoplasia asociada a tumores persiste si el tumor no remite, lo que facilita la movilidad de las células tumorales, la invasión de los tejidos adyacentes y, en última instancia, la intravasación a los vasos sanguíneos o linfáticos. Por lo tanto, la desmoplasia tumoral se asocia con la formación de metástasis. Nuestra investigación tiene como objetivo entender esta respuesta y la influencia de las nuevas propiedades químicas y físicas del entorno tumoral en la formación de metástasis.
Nuestros resultados nos han permitido describir cómo los fibroblastos asociados a tumores (CAF) incrementan la composición, rigidez y organización tridimensional de las fibras extracelulares y cómo estos parámetros promueven la invasión tumoral. A nivel molecular, hemos descrito que la actividad de un factor de transcripción llamado Snail1 regula de manera análoga la desmoplasia causada por los CAF, los fibroblastos asociados a heridas y los fibroblastos activados en los procesos fibróticos. Snail1 es un represor transcripcional pero en estos fibroblastos también puede actuar como activador transcripcional y como factor de splicing. Hemos definido algunos elementos moleculares, tales como la subunidad RelA (p65) del factor nuclear-kB (NF-kB), PARP1 y PRMTs1-4, que colaboran con Snail1 para incrementar la transcripción de moléculas de la matriz extracelular, como la fibronectina. Snail1 también es necesario para la actividad enzimática de RhoA, que controla la reorganización del citoesqueleto de los fibroblastos y permite la polimerización de las fibras extracelulares, aunque el mecanismo aún debe estudiarse en detalle.
Al analizar carcinomas infiltrantes de mama hemos demostrado la relevancia de Snail1 en la progresión del tumor. La detección inmunohistoquímica de Snail1 en los fibroblastos del estroma tumoral es un indicador muy fiel de mal pronóstico. Por interés terapéutico, hemos aprovechado los datos que indican que las metiltransferasas PRMT1 y 4 colaboran con Snail1 para reducir la formación de metástasis mediante la inyección de inhibidores de la metiltransferasa en un modelo de cáncer de ratón (figura 1).
Con nuestra investigación actual buscamos mejorar el conocimiento de la regulación molecular de los fibroblastos asociados a tumores. Estamos explorando las acciones de Snail1 en la matriz extracelular mediante el control del splicing alternativo de moléculas estructurales. Por lo tanto, estamos describiendo cómo el splicing está regulado por Snail1 y qué papeles desempeñan algunas variantes de splicing en las propiedades metastásicas de las matrices. Sopesamos la posibilidad de utilizar inhibidores específicos de splicing basados en nucleótidos modificados como herramientas farmacológicas antimetastásicas, ya que es una estrategia que se utiliza con éxito en patologías asociadas a variantes de splicing anormales.
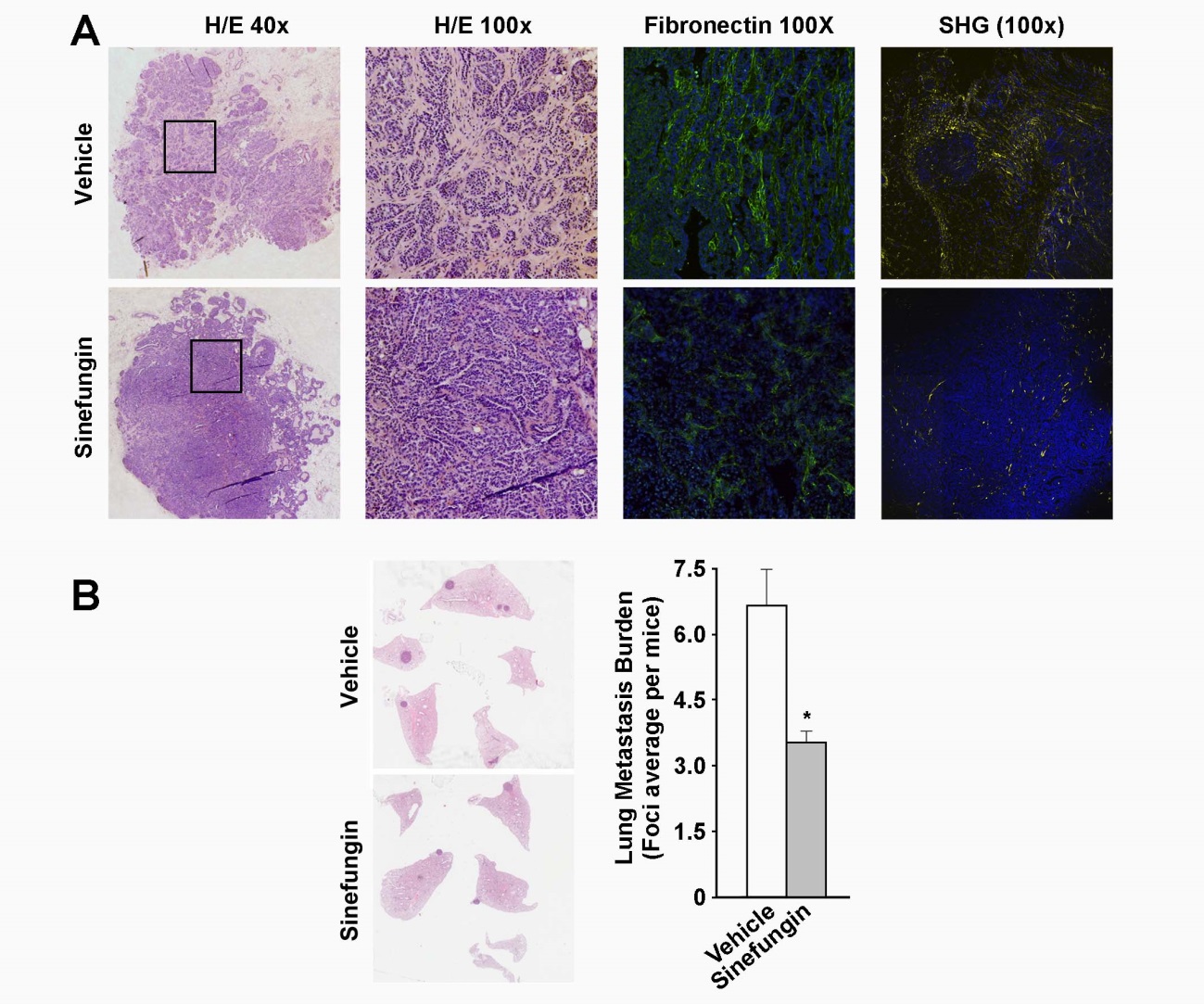
Figura 1. La sinefungina previene la reacción estromal y disminuye la metástasis en ratones. A) Tumores primarios de mama en ratones tratados o no con sinefungina fueron analizados por inmunohistoquímica (tinción de hematoxilina-eosina), inmunofluorescencia (fibronectina) o generación de segundo armónico (colágeno). El componente estromal de los tumores se redujo en los ratones tratados. B) Se contaron los focos metastásicos pulmonares. El gráfico muestra que el tratamiento con sinefungina reduce la carga metastásica en los pulmones. De Sala et al., 2019.
Cuatro publicaciones recientes del grupo:
© Institut Hospital del Mar
d'Investigacions MèdiquesAviso legal y Política de Privacidad | Política de cookies | Mapa Web | Accesibilidad | Dirección y accesos | Contacto